QPCTL
QPCTL 的小分子抑制劑作為腫瘤的潛在治療方法,與 CD47 訊號調節蛋白 α(「SIRPα」)軸高度結合
-
項目狀態:
第 1 期臨床試驗 -
與復星醫藥共同開發
已完成試驗

酶活性研究

毒理學研究

體外基於細胞的

可開發性/CMC

體外 ADMET 研究

體內急性效用研究

體內 PK 研究

體內 PK-PD

單藥療法體內效用研究

體內抗腫瘤效用研究
利妥昔單抗、抗 PD-1 或紫杉醇、阿扎胞苷的聯合研究
靶點機制
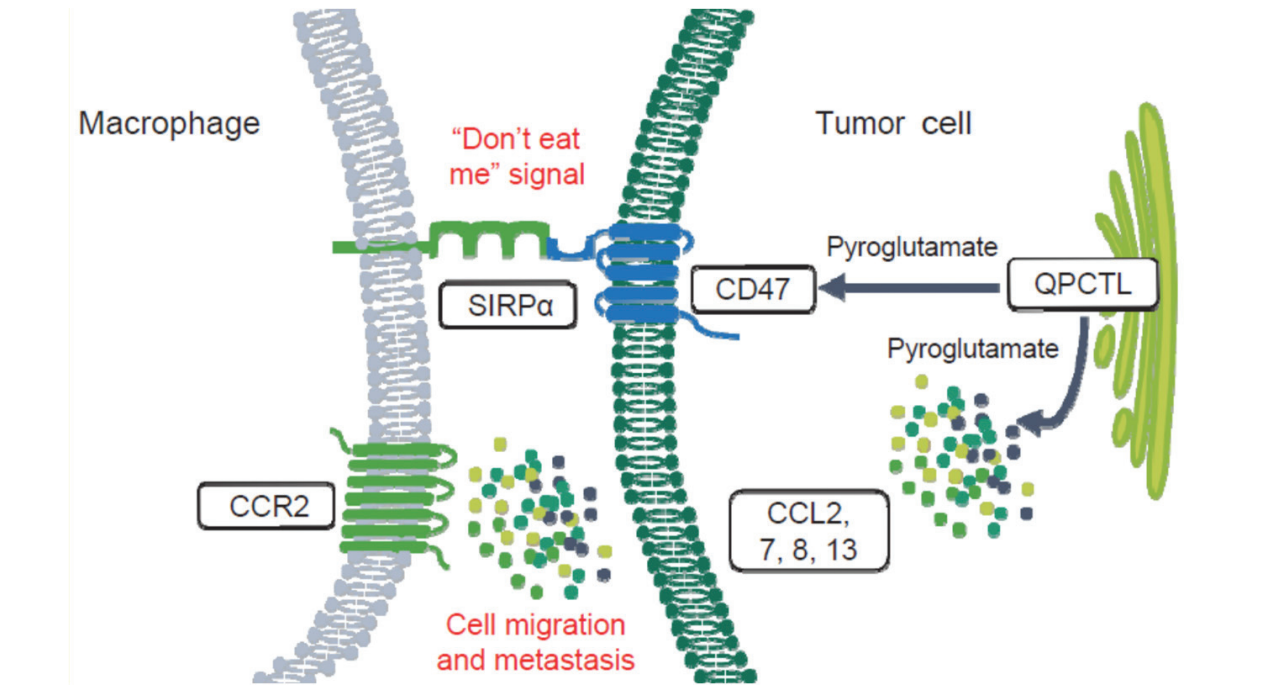
QPCTL 位於稱為高爾基體的細胞器上,已被確定為 CD47-SIRPα 軸(通常稱為「別吃我」軸)的關鍵調節因子。
使用藥理工具或生物工程敲除法抑制QPCTL已經證明可導致CD47與SIRPα之間的結合減少或喪失,以及增加抗體依賴性細胞吞噬作用及嗜中性粒細胞誘導的細胞毒性。鑒於成熟紅血球中缺乏QPCTL定位的高爾基體,與目前臨床開發中的大多數CD47阻斷劑相比,QPCTL抑制劑引起的血液學毒性可能性較低。
使用藥理工具或生物工程敲除法抑制QPCTL已經證明可導致CD47與SIRPα之間的結合減少或喪失,以及增加抗體依賴性細胞吞噬作用及嗜中性粒細胞誘導的細胞毒性。鑒於成熟紅血球中缺乏QPCTL定位的高爾基體,與目前臨床開發中的大多數CD47阻斷劑相比,QPCTL抑制劑引起的血液學毒性可能性較低。
此外,透過抑制 QPCTL 下調 CCL2/CCR2 訊號傳導,可用於透過調節抑制性骨髓細胞向吞噬富巨噬細胞特性轉化重新編程腫瘤免疫微環境,隨後將 T 細胞發炎程度較低的腫瘤轉為 T 細胞浸潤程度較高的腫瘤,並進一步有利抗 PD-1/L1 抗體等 T 細胞接合者所引導的抗腫瘤免疫。
英矽智能 QPCTL 抑制劑摘要 — 第 1 期臨床試驗
- 人工智能生成的創新結構
- 英矽智能的人工智能小分子生成平台 Chemistry42 生成的不同結構
- 有效的癌症免疫治療
- SIRP-α 與表達 CD47 的癌細胞結合的有效抑制活性
- 創新型 I/O 類利用先天免疫,並透過將腫瘤骨髓景觀重新編程為抗腫瘤特性來進一步增強適應性免疫
- 潛在的廣泛適應症包括 NHL/AML 和實體瘤
- 口服良好成藥性
- 良好的體外 ADME 特性
- 不同臨床前動物物種的有前景 PK 特性
- 優秀的安全窗
- 基於 GLP 研究,MOS 在大鼠和犬中具有前景,沒有明顯的脫靶毒性
- 通過安全藥理學
適應症
透過先天免疫檢查點誘導的吞噬作用檢測和清除癌細胞,在腫瘤介導的免疫逃脫中發揮重要作用。CD47-SIRPα 軸的訊號傳導由 QPCTL 維持,是描述最充分的先天免疫檢查點,它允許表達 CD47 的癌細胞逃避先天免疫細胞介導的吞噬作用。目前正在多項正在進行的試驗中評估阻斷 CD47-SIRPα 相互作用的藥物,大多數與促吞噬劑聯合使用,例如治療性抗體,白血病、淋巴瘤和晚期實體瘤(頭頸鱗狀細胞癌、胃癌、乳癌、大腸癌等)患者的化療。
QPCTL 抑制劑可以為具有這些適應症的患者開發,特別是當他們對標準治療方法(例如阿扎胞苷、利妥昔單抗、紫杉醇、曲妥珠單抗、西妥昔單抗等)表現出抗藥性時。
項目狀態 — 第 1 期臨床試驗
目前與復星集團合作開發一款首創的口服 QPCTL 小分子抑制劑,QPCTL 是 CD47-SIRPα 軸的調節因子,用於癌症免疫治療。初步結果表明,其具有強大的酶抑制活性、強大的效用並且與其他治療方法有協同作用。我們於 2023 年 4 月向中國國家藥品監督管理局提交了 IND 申請,預計於 2023 年下半年啟動第 I 期臨床試驗。
透過利用我們的 Pharma.AI 平台發現。我們利用 PandaOmics 的靶點識別和商業情報功能來識別新的腫瘤學靶點,QPCTL 被列為有前景的創新可成藥靶點之一,對 CD47-SIRPα 軸產生一定影響。然後,我們使用 Generative Chemistry 來生成針對 QPCTL 的候選藥物,用於治療 CD47-SIRPα 軸高度參與的腫瘤。

與腫瘤調理抗體合併使用時,對腫瘤生長有協同抑制作用






